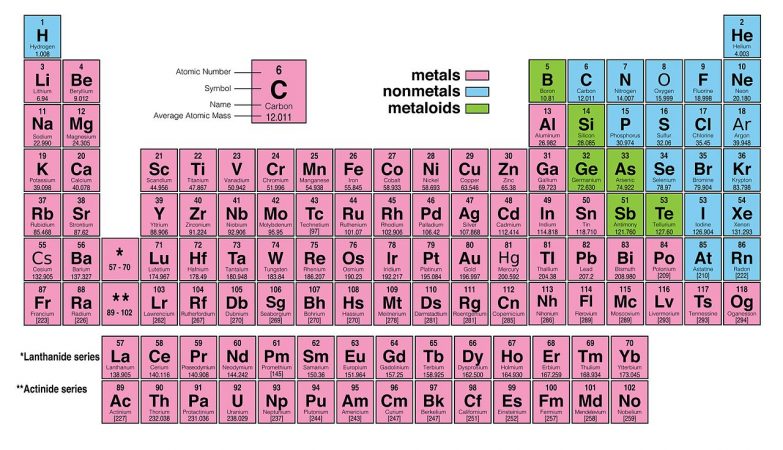
A famosa tabela periódica é omnipresente nas escolas e laboratórios de química. O crédito para sua criação geralmente vai para Dimitri Mendeleev, mas ele não foi o primeiro a tentar classificar os elementos.
Em 1869, o químico russo escreveu os elementos conhecidos – 63 na época – em cartões e organizou-os em colunas e linhas de acordo com as suas propriedades químicas e físicas. Para celebrar o 150º aniversário deste momento crucial da ciência, a ONU proclamou 2019 como o “ano internacional da tabela periódica”.
Ao longo dos anos, muitos cientistas propuseram-se a organizá-los de diferentes formas. Décadas antes do russo, por exemplo, o químico John Dalton elaborou uma tabela, bem como alguns símbolos bastante interessantes para os elementos.
E, apenas alguns anos antes de Mendeleev, John Newlands também criou uma tabela classificando os elementos pelas suas propriedades.
O que aconteceu na versão de Mendeleev foi que o russo reconheceu que certos elementos estavam a faltar. Então, onde Dalton, Newlands e outros escreveram somente o que era conhecido, Mendeleev deixou espaço para o desconhecido. Ainda mais surpreendente, previu com precisão as propriedades dos elementos que faltavam.
Mendeleev deixou alguns pontos de interrogação na sua tabela. Por exemplo, ao lado de Al (alumínio) há espaço para um metal desconhecido. O químico previu que teria uma massa atómica de 68, uma densidade de seis gramas por centímetro cúbico e um ponto de fusão muito baixo.
Seis anos depois, Paul Émile Lecoq de Boisbaudran isolou o gálio com uma massa atómica de 69,7, uma densidade de 5,9g por centímetro cúbico e um ponto de fusão tão baixo que se torna líquido na mão.
Mendeleev fez o mesmo para o escândio, o germânio e o tecnécio – que só foi descoberto em 1937, 30 anos após a sua morte.
Apesar disso, existem também diferenças fundamentais entre essa primeira versão de Mendeleev e a tabela a que estamos habituados. Por um lado, a atual tem elementos que o russo ignorou – principalmente os gases nobres (como hélio e o néon). Além disso, a tabela inicial é orientada de maneira diferente que a versão moderna, com elementos que agora colocamos juntos em colunas dispostas em linhas.
Quando giramos a 90 graus a tabela de Mendeleev, a semelhança com a versão moderna torna-se aparente. Por exemplo, os halogénios – flúor (F), cloro (Cl), bromo (Br) e iodo (I, com o símbolo J na tabela de Mendeleev – todos aparecem próximos uns do outro. Hoje, estão organizados na 17ª coluna da tabela (ou grupo 17).
A origem e a evolução da tabela de Mendeleev, no entanto, não significaram o fim da experiência – houve muitas tentativas de dar layouts alternativos aos elementos.
Versões alternativas
Um exemplo particularmente notável é a espiral de Heinrich Baumhauer, publicada em 1870, com o hidrogénio no centro e elementos com massa atómica crescente a girar para fora. Os elementos que caem em cada um dos raios da roda partilham propriedades comuns, assim como aqueles numa coluna (ou grupo) na tabela de hoje.
A Tabela Espiral de Theodor Benfey, construída pelo filologista alemão em 1964, é um outro exemplo de uma tabela com os elementos organizados em espiral.
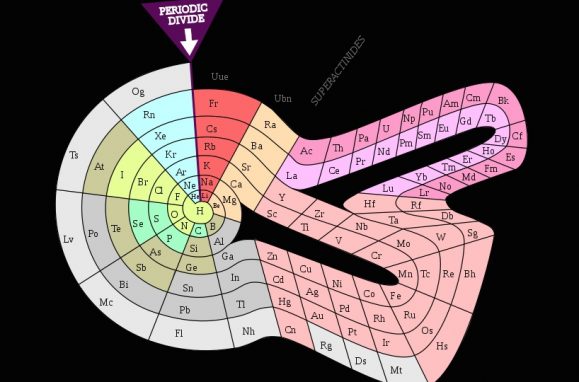
Outra formulação da Tabela Periódica é o formato de “infinito” de Henry Basset, criado em 1892.
No início do século XX, a tabela estabeleceu-se num formato horizontal, como a versão aparentemente contemporânea de Alfred Werner em 1905. Pela primeira vez, os gases nobres apareceram na sua posição à direita da tabela. Werner também deixou lacunas para futuras descobertas, embora tenha exagerado nas previsões, com sugestões de elementos mais leves que o hidrogénio, bem como um entre o hidrogénio e o hélio (que não existem).
Uma versão particularmente influente foi a de Charles Janet, de 1928. Ele adotou a abordagem de um físico para a tabela, usando uma teoria quântica recém-descoberta para criar um layout baseado em configurações de eletrões. A tabela resultante é até hoje privilegiada por muitos físicos. Curiosamente, Janet também forneceu espaço para elementos até ao número 120, apesar de apenas 92 serem conhecidos na época. Estamos agora com 118:
A tabela atual é uma evolução direta da versão de Janet. O problema com o antigo formato é que é muito alongado. Portanto, em grande parte por razões estéticas, os elementos do bloco f são geralmente cortados e depositados por baixo da tabela principal.
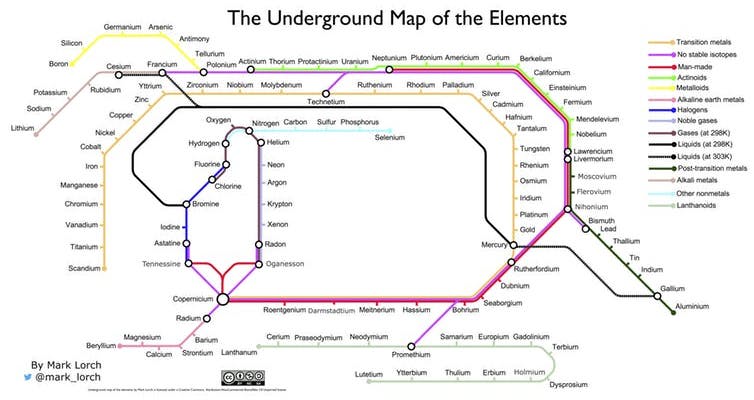
Mas uma das mais criativas abordagens ao design da Tabela Periódica é a do professor e químico britânico Mark Lorch, que organizou a lista dos elementos usando a colorida sinalética do Metro de Londres – obtendo um “Mapa Periódico dos Elementos” que em tudo nos faz lembrar o traçado das linhas do icónico mapa do Underground.